众所周知,活细胞密度(VCD)和活率(viability)是评估哺乳动物细胞系生长状态的重要指标。生物制药研发人员进行悬浮细胞培养,每天所不能避免的工作,就是取样计数。使用细胞计数板进行人工计数无疑是金标准方法。
但这个传统方法其劳动强度十分惊人,样品量少的时候还能吃得消,样品量大一些,甚至于要做大规模的DOE实验时,估计很多实验人员想死的心都会有。而且人工计数有较强的主观性,对操作人员的经验及操作熟练度有一定要求,导致有时候数据的重现性和可比性会受到质疑。

幸好,细胞计数仪,尤其是高通量的自动细胞计数仪的出现,让我们看到曙光。最早出现的是基于台盼蓝染色法结合智能图像识别技术的计数仪,后来又相继出现简化至流式细胞仪和应用库尔特原理的设备。这些设备不同程度地为实验人员减少了繁琐的实验步骤,大大提升了实验效率。
但与此同时,在设备的使用过程中,很多实验人员却会发现,不同设备间的数据有时会存在差异,而且与人工计数的结果也可能存在偏差 。
那我们该如何评价与验证计数结果的准确性呢?来自瑞士的三位科学家在Journal of Biotechnology上发布的一项独立研究结果就给了我们一些思路。研究中,他们使用自己开发的一套双荧光染色方法,将在贝克曼公司的CytoFLEX®流式细胞仪上的CHO-K1细胞计数结果,与手工计数及经验证的默克密理博Guava®easyCyte HT计数结果相比较,从而评价前者的特异性、准确度、精密度和重复性。这些实验包括:
1、软件系统的比较:对是否有预设参数、是否为开发平台进行了考量;
2、VCD测试重复性比较:通过对同一样品的多次重复测试,比较VCD的标准平均偏差及测试的报错率;
3、分析速度比较:通过连续自动进样24个,比较不同系统的分析时长;
4、活率测试准确性比较:通过对同一样品的多次重复测试,比较不同方法活率结果的差异;
5、线性范围比较:通过梯度稀释,测试出两个系统的检出限及线性范围;
此外,他们验证了在一次Fed-Batch中Day3~Day10的样品是否能在同一稀释比例下准确计数。
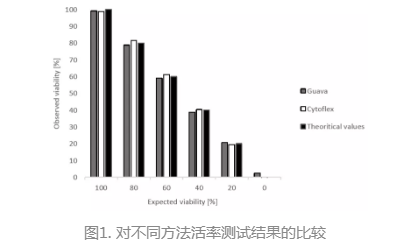
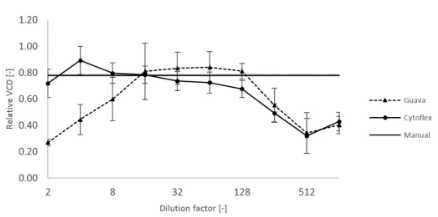
由此,他们得出结论是CytoFLEX®系统可以作为一个快速可靠的高通量细胞计数方法而被采纳。
三位科学家在文末不忘强调,该研究未受资助:-) 。但无论如何,他们所采用的验证方法是值得我们参考的。而细胞计数仪也有许多,功能参数各不相同,也各有优劣。我们归类整理一下,大致如下:
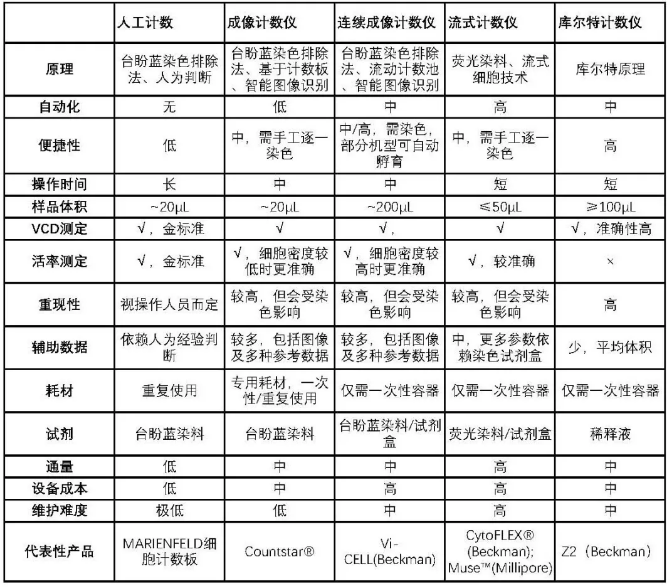
当然了,鱼与熊掌不可兼得,我们有必要用严谨的方法进行评估和选择最合适自己的系统。毕竟,只有合适的才是最好的。
QuaCell®技术团队凭借丰富的项目经验,开展从细胞株构建、培养基开发、至工艺优化的一站式CRO服务,助推生物制药上游研发进程,提供全程GMP文件体系及IND申报支持。
END
排版丨贺沃希
www.hwashin.com.cn
更多精彩等着你

Copyright ©Hwashin Tech Co., Ltd.—上海代表处 版权所有 地址:上海市闵行区中春路6818弄10号海琪大厦 网站地图